9月18日,NMPA官網發布最新一批藥品獲批信息,海思科的注射用鹽酸頭孢替安通過一致性評價,成為該產品首家過評企業。注射用鹽酸頭孢替安是中國公立醫療機構終端頭孢類注射劑的TOP16產品。
圖1:最新獲批的產品情況
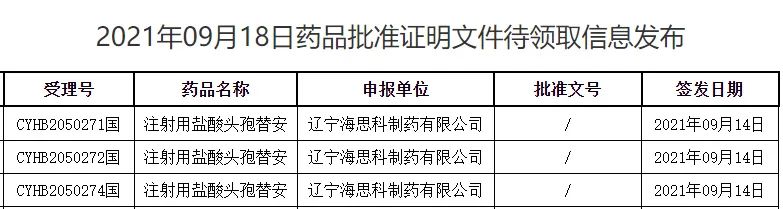
作為第二代頭孢菌素類抗生素,鹽酸頭孢替安抗菌譜廣泛而均衡,對革蘭氏陰性菌及陽性菌都顯示了廣泛的抗菌作用。據米內網數據顯示,2020年在中國城市公立醫院、縣級公立醫院、城市社區中心及鄉鎮衛生院(簡稱中國公立醫療機構)終端,注射用鹽酸頭孢替安的銷售額在13億元以上,目前領軍市場的是上藥新亞藥業(40.95%),遼寧海思科制藥排在TOP6(3.26%)。
從一致性評價補充申請情況來看,早前已有6家國內藥企申報,最早是上藥新亞藥業在2020年2月提交,目前在審評審批中;遼寧海思科制藥在2020年5月提交,如今順利反超拿下首家過評;此外,哈藥集團制藥總廠、重慶圣華曦藥業、浙江永寧藥業以及山東羅欣藥業集團的受理號也正在審評審批中。
表1:海思科早前過評/視同過評產品情況
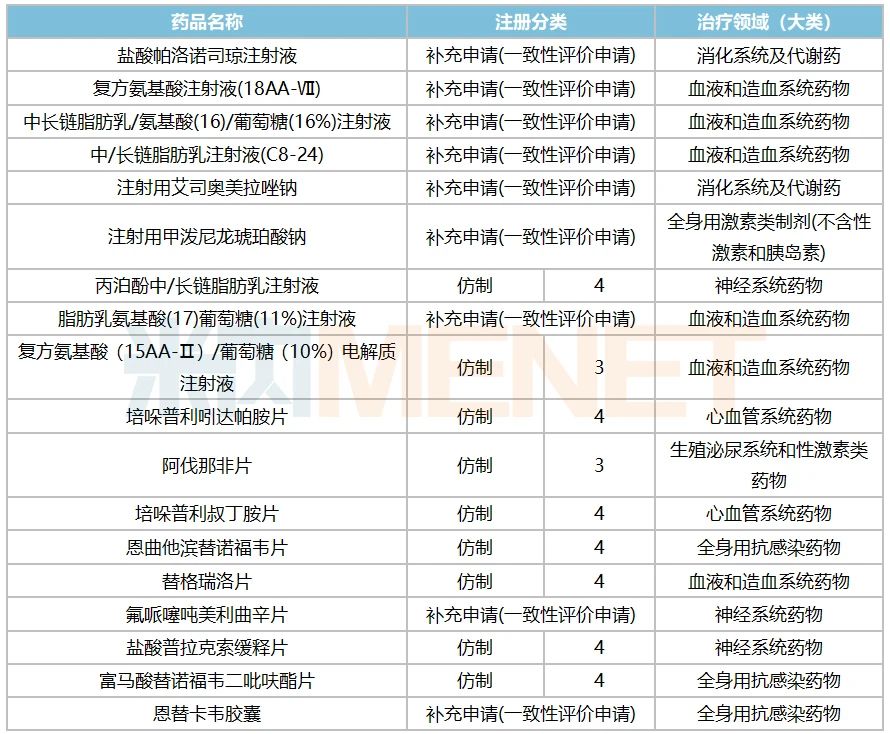
米內網數據顯示,截至目前,海思科及子公司已過評/視同過評的產品達19個(含本次獲批產品),其中10個為注射劑。培哚普利叔丁胺片、恩曲他濱替諾福韋片及鹽酸普拉克索緩釋片中標第四批國采,注射用艾司奧美拉唑鈉、鹽酸帕洛諾司瓊注射液以及脂肪乳氨基酸(17)葡萄糖(11%)注射液中標第五批國采。